Ecco la spiegazione dei legami chimici
http://www.ovo.com/legami-chimici
Translate
lunedì 19 novembre 2012
Legami chimici
IL LEGAME CHIMICO
Si ha un legame chimico quando una forza di natura elettrostatica tiene uniti più atomi in una specie chimica o più molecole in una sostanza allo stato condensato .
Si ha un legame chimico quando una forza di natura elettrostatica tiene uniti più atomi in una specie chimica o più molecole in una sostanza allo stato condensato .
I legami chimici "più forti" hanno un contenuto energetico maggiore e sono più difficili da rompere, mentre i legami "più deboli" hanno un contenuto energetico minore e sono più facili da rompere. Da ciò deriva che le molecole che hanno al loro interno legami chimici più deboli sono più instabili.[1]
Inoltre tanto più un legame è forte, tanto minore è la lunghezza del legame, essendo la forza che tiene uniti gli atomi maggiore. Prendiamo ad esempio il catione H2+: esso è costituito da due nuclei di H e da un elettrone. Indichiamo con Ha il primo nucleo di idrogeno e con Hbl'altro nucleo di idrogeno. A ciascuno dei due nuclei è associata una funzione d'onda elettronica, rispettivamente 1sa e 1sb, la cuicombinazione lineare forma l'orbitale molecolare Ψ
.Natura elettrostatica del legame chimico
Ψ avrà valori bassi tra i due nuclei, mentre crescerà avvicinandosi ad essi e poi decrescerà allontanandosi nuovamente da essi. Quindi se si considera un elettrone, ovvero una carica negativa posta tra i due nuclei, esso sarà sottoposto a forze attrattive da parte dei due nuclei che saranno controbilanciate da quelle repulsive fino a quando non si sarà raggiunta la stabilità del sistema; quindi l'elettrone sarà caduto in una buca di potenziale dalla quale gli sarà difficile uscire. In tal modo si è formato un legame chimico.
Legame covalente
Il legame covalente è il legame che si instaura tra due atomi appartenenti alla categoria (degli elementi chimici) dei non metalli (uguali o aventi differenza di elettronegatività - scala di Pauling - compresa tra 0 e 0,4) che mettono in compartecipazione una coppia di elettroni (detti coppia di legame) in un orbitale esterno che abbraccia entrambi gli atomi. Il legame covalente viene rappresentato da un trattino che congiunge i due atomi legati.
Legame covalente puro
Un legame covalente puro (o omopolare) è un legame covalente che s'instaura fra due atomi appartenenti allo stesso elemento. In pratica si stabilisce una interazione (cioè il legame) tra atomi dello stesso tipo: è il caso tipico dell'idrogeno, dell'ossigeno, dell'azoto atmosferico, ecc.

Essendo la nube elettronica distribuita simmetricamente, il legame risulta non polarizzato.
I legami covalenti che si formano fra due atomi che condividono due coppie di elettroni prendono il nome di doppio legame. I legami covalenti che si formano fra due atomi che condividono tre coppie di elettroni prendono il nome di triplo legame.
Per constatare il numero di legami covalenti formatisi fra due atomi bisogna conoscere la valenza dell'atomo degli elementi considerati e dopo aver fatto questo scoprire quanti elettroni gli mancano per essere stabili (regola dell'ottetto).
es. N=azoto V gruppo= 5 elettroni di valenza (+ 3 elettroni per completare l'ottetto)
I legami fra due azoti sono un triplo legame.
Legame covalente polare
Il legame covalente polare si instaura tra due atomi con differenza di elettronegatività compresa tra 0,4 e 1,9. In questo caso, gli elettroni coinvolti nel legame risulteranno maggiormente attratti dall'atomo più elettronegativo, il legame risulterà quindi polarizzato elettricamente, cioè ognuno degli atomi coinvolti nel legame presenterà una carica elettrica parziale.
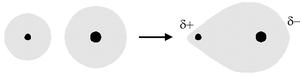
Quando una molecola è tenuta coesa da soli legami covalenti puri o possiede una simmetria tale da annullare reciprocamente le polarità dei suoi legami covalenti risulterà complessivamente apolare. Invece una molecola costituita da due atomi legati fra loro da un legame covalente polare è polare (o dipolo elettrico); ciò non significa, in genere, però che la molecola abbia una carica elettrica perché nella sua totalità essa è elettricamente neutra. Si può prevedere facilmente la struttura polare di una molecola nel caso essa sia biatomica.
mercoledì 14 novembre 2012
Gli elementi
Un'altra tavola periodica,ma questa volta con un signore che sembra una pecora(cit. professore) molto simpatico,che ci spiegherà,con dei video le proprietà degli elementi.
http://www.goorulearning.org/gooru/index.g#!/r/1c6a5f79-9007-4f11-9da8-f0b7d55fb167
http://www.goorulearning.org/gooru/index.g#!/r/1c6a5f79-9007-4f11-9da8-f0b7d55fb167
Tavola periodica
Ecco qui una tavola periodica (ptable) da cui ricavare molte nozioni su ogni elemento
http://www.ptable.com/?lang=it
http://www.ptable.com/?lang=it
L'atomo,storia e struttura
Questo link parla della storia dell'atomo.
http://gianluca1989.blogspot.it/2009/01/storia-dellatomo.html
Questo invece parla di tutto ciò che si è affrontato in chimica finora. Mi pare ben fatto! Ora sta a voi trovarne l'utilità.
http://gianluca1989.blogspot.it/2009/01/storia-dellatomo.html
Questo invece parla di tutto ciò che si è affrontato in chimica finora. Mi pare ben fatto! Ora sta a voi trovarne l'utilità.
Iscriviti a:
Commenti (Atom)
